|
Učebný cieľ kapitoly
Cieľom tejto kapitoly je zvládnutie problematiky termodynamiky vodnej pary vrátane jej diagramov. Čitateľ by mal vedieť určiť parametre vodnej pary v oblasti mokrej, sýtej i prehriatej pary použitím i - s diagramu. Mal by vedieť použiť tento diagram na zostavenie expanznej čiary ideálnej i skutočnej expanzie pary v parnej turbíne.
Pary vznikajú pri zmene skupenstva kvapalného na plynné. V tejto súvislosti hovoríme o nasledujúcich procesoch:
- Vyparovanie je premena kvapaliny na paru pri teplote bodu varu pri danom tlaku. Teplota bodu varu závisí od tlaku, s rastúcim tlakom rastie a naopak. Pri konštantnom tlaku sa teplota v priebehu vyparovania nemení. Ak je vznikajúca para v styku s vyparujúcou sa kvapalinou, nemôže teplota žiadnej zložky prekročiť teplotu bodu varu. Teplotu pary možno zvyšovať až po odparení celého množstva kvapaliny, resp. ak sa para oddelí od odparujúcej sa kvapaliny, ako je to pri prehrievačoch parných kotlov.
- Odparovanie je tvorenie pary len na povrchu kvapaliny pri rôznych teplotách. Podstata tohto procesu spočíva v tom, že molekuly kvapaliny na jej povrchu, ktoré majú vzhľadom na ostatné veľkú kinetickú energiu, prekonávajú tiažové sily a vyletujú do okolitého priestoru. Intenzita odparovania rastie s teplotou. Pri odparovaní klesá teplota kvapaliny, pretože stratou molekúl s veľkou kinetickou energiou sa stredná kinetická energia kvapaliny znižuje. Kvapalina sa môže celkom odpariť, ak je nad ňou neobmedzený priestor, t.j. vzduch sa nemôže nasýtiť.
- Var. Pri prívode tepla kvapaline sa zvyšuje jej teplota. Pri určitej teplote, závislej od druhu kvapaliny a tlaku, nastáva vyparovanie v celom objeme. Bublinky pary vznikajú na povrchu výhrevnej plochy aj vo vnútri kvapaliny. Tento proces sa nazýva var. Intenzita vznikania bubliniek na povrchu výhrevnej plochy závisí od hustoty tepelného toku do nej dodávanej [Wm-2]. Pri určitej - kritickej hodnote zlejú sa bublinky na výhrevnej ploche v jeden celok a vytvoria súvislú parnú blanu. Vzniká tak z varu, zvaného bublinkový, var zvaný blanový. Blanový var je pri parných generátoroch nežiadúci jav, pretože parná blana predstavuje tepelný izolátor, ktorý znižuje intenzitu prenosu tepla.
- Kondenzácia je premena pary na kvapalinu, t.j. proces opačný ako var, vyvolaný odnímaním tepla pare. Analogicky ako pri vare môže existovať kondenzácia kvapková alebo blanová. Charakter kondenzácie závisí - okrem intenzity chladenia povrchu - od zmáčanlivosti kondenzujúcej kvapaliny.
- Sublimácia je premena látky zo stavu tuhého priamo na stav plynný (bez prechodu cez stav kvapalný).
- Desublimácia je opačný proces ako sublimácia.
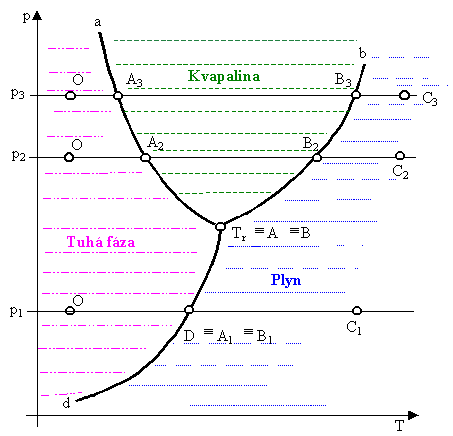
obr.6.1 Oblasti skupenstva látky
|
Existencia látok v tuhom, kvapalnom či plynnom skupenstve závisí od tlaku a teploty. Sledujme teraz tieto premeny, vyvolané dodávkou tepla, v diagrame p-T obr. 6.1. Predpokladajme, že určitej látke v tuhom stave budeme dodávať teplo pri konštantnom tlaku (napr. zo stavu "0" pri tlaku p2). Potom sa uskutočnia nasledujúce procesy:
- zohrievanie na teplotu tavenia tA (0-A) a rozpustenie pri tejto teplote
- zohrievanie kvapaliny na teplotu bodu varu tB (A-B) a jej odparenie pri tejto teplote (sprevádzané značným rastom objemu)
- prehrievanie pary z teploty bodu varu na teplotu vyššiu (B-C)
Pri zmene tlaku bude sa poloha bodov A, B v diagrame meniť. Ak bude skúmanou látkou voda, potom s rastúcim tlakom (napr. pri tlaku p3) bude sa bod A3 približovať k osi p (pretože s rastúcim tlakom sa znižuje teplota topenia ľadu) a naopak - bod B vzďaľovať od osi p (pretože s rastúcim tlakom rastie teplota bodu varu), t.j. s rastúcim tlakom budú sa body A, B od seba vzďaľovať a naopak s klesajúcim tlakom približovať. Množina všetkých stavov A je medzná krivka a, oddeľujúca oblasť tuhej fázy od fázy kvapalnej, množina všetkých stavov B je medzná krivka b, oddeľujúca oblasť kvapalnej fázy od fázy plynnej.
Pri znižovaní tlaku sa obidve krivky postupne približujú až pri určitom tlaku sa stretnú v bode Tr, ktorý sa nazýva trojný bod. Každá látka má v trojnom bode jednoznačné hodnoty stavových veličín, napr. voda: pTr = 0,612 kPa; tTr = 0,01°C. Každá látka môže pri tlaku a teplote zodpovedajúcej trojnému bodu (patrí súčasne krivke a a b) existovať vo fáze tuhej, kvapalnej aj plynnej.
Ak privádzame teplo tuhej látke pri tlaku nižšom ako zodpovedá trojnému bodu (napr. pri tlaku p1 z východiskového stavu "0"), potom látka pri určitej teplote, zodpovedajúcej bodu D, prejde priamo zo stavu tuhého priamo na stav plynný bez toho, že by prešla stavom kvapalným. Tento proces sme už definovali ako sublimáciu. Ak vynesieme do diagramu všetky body D pri p < pTr, dostávame medznú krivku d, ktorá určuje teplotu sublimácie v závislosti od tlaku a oddeľuje oblasť tuhej fázy od plynnej.
V energetických strojoch sa používa ako pracovné médium voda a vodná para s parametrami dostatočne vzdialenými od medzných kriviek a a d na obr. 6.1. Budeme sa preto ďalej zaoberať len oblasťou kvapalnej a plynnej fázy vody v súradnicových systémoch v technickej termodynamike používaných, t.j. p-v, T-s, i-s.
V praxi sa používa zriedka, avšak pre objasnenie zmien, ktoré pri premene vody na paru prebiehajú, je najvhodnejší.
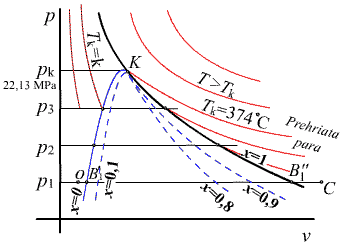
Sledujme proces dodávky tepla vode pri p = const. na obr. 6.2. Za počiatočný stav zvoľme napr. stav "0" pri tlaku p1 = 0,1 MPa a teplote o niečo vyššej ako 0°C. S dodávkou tepla sa zvyšuje teplota vody, čím rastie jej objem až do bodu B'1, pri ktorom dosiahne teplotu bodu varu tB1 = t' (pre tlak 0,1 MPa je t'= 100°C).
obr.6.2 p-v diagram vodnej pary
|
Objem zodpovedajúci bodu B' označme 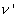 . Teplo, prevedené od stavu "0" do stavu B' sa nazýva kvapalinové teplo q0,B' = qk [Jkg-1]. Je to množstvo tepla, potrebné na izobarický ohrev 1 kg vody z teploty 0°C na teplotu bodu varu pri danom tlaku. . Teplo, prevedené od stavu "0" do stavu B' sa nazýva kvapalinové teplo q0,B' = qk [Jkg-1]. Je to množstvo tepla, potrebné na izobarický ohrev 1 kg vody z teploty 0°C na teplotu bodu varu pri danom tlaku.
Pri ďalšej dodávke tepla vzniká para, objem rýchlo narastá. Pracovná látka je zmes vody a pary, ktorú nazývame mokrou parou. Jej zloženie udávame hmotnostnou koncentráciou pary v zmesi, tzv. suchosťou pary - x:
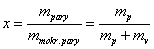
|
Napr. x = 0,9 znamená, že v mokrej pare je ešte 10% vody. Pokiaľ sa všetka voda neodparí, je teplota v priebehu odparovania stála (samozrejme, predpokladáme stále p = const.). Odparovanie je ukončené v bode B'', ktorému zodpovedá teplota tB'' = t'' , pričom t'' = t', čo znamená, že izoterma je na úseku B1', B1'' totožná s izobarou. Para v bode B'' má teplotu bodu varu pri danom tlaku, neobsahuje však žiadnu vodu a nazývame ju suchou alebo sýtou parou. Na zmenu stavu z B'(bod varu) do B'' (sýta para) treba dodať tzv. výparné teplo - r [Jkg-1]. Ak budeme zo stavu B'' ďalej dodávať teplo, bude sa zvyšovať teplota a objem pary, z pary suchej sa stane para prehriata. Rozdiel teplôt, zodpovedajúci stavom B'' a C, t.j. tc - tB'' sa nazýva prehriatie pary a teplo qC-B'' = qpr [Jkg-1] prehrievacie teplo.
Zopakujme tento proces pre iné tlaky p2, p3, ... atď. a na každej izobare vyznačme charakteristické body B', B'', v ktorých sa z hľadiska fázy mení kvalita procesu. Spojením všetkých stavov daných bodmi B', t.j. stavov bodu varu, dostávame tzv. dolnú medznú krivku - DMK, spojením všetkých stavov daných bodmi B'', t.j. stavov sýtej pary, dostávame tzv. hornú medznú krivku - HMK. HMK a DMK rozdeľujú celý diagram podľa obr. 6.2 na tri oblasti:
Oblasť vody (vľavo od DMK), oblasť mokrej pary (medzi DMK a HMK) a oblasť prehriatej pary (vpravo od HMK). Podľa definície je zrejmé, že hodnota suchosti na DMK - x = 0 a na HMK - x = 1, celá oblasť medzi DMK a HMK je rozdelená čiarami konštantnej suchosti 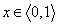 . .
Stavové veličiny na DMK sa označujú s jednou čiarkou (v', u', i', s'), veličiny na HMK s dvoma čiarkami (v'', u'', i'', s''). Sú usporiadané v parných tabuľkách podľa tlakov a teplôt.
S rastúcim tlakom sa oblasť odparovania B', B'' neustále zužuje výparné teplo klesá, až pri určitom tlaku splynú obidva body v jeden, zvaný kritický bod - K 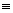 B' B'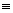 B'', t.j. voda prechádza v sýtu paru bez postupného zväčšovania objemu, bez prechodu cez oblasť mokrej pary. Stavové veličiny kritického bodu sa nazývajú kritické a označujú sa pk, vk, tk. Pre vodu je kritický tlak pk = 22,13 MPa a jemu zodpovedajúca kritická teplota tk = 374°C (je teplotou bodu varu pre tlak pk). Pri vyššom tlaku ako pk premení sa voda v sýtu paru pri teplote tk, kritická izoterma tk je hranicou medzi vodou a prehriatou parou pri nadkritických tlakoch. Pri teplote vyššej ako je kritická teplota tk = 374°C, nemôže voda existovať v kvapalnom stave, všetky izotermy t > tk ležia v oblasti prehriatej pary. B'', t.j. voda prechádza v sýtu paru bez postupného zväčšovania objemu, bez prechodu cez oblasť mokrej pary. Stavové veličiny kritického bodu sa nazývajú kritické a označujú sa pk, vk, tk. Pre vodu je kritický tlak pk = 22,13 MPa a jemu zodpovedajúca kritická teplota tk = 374°C (je teplotou bodu varu pre tlak pk). Pri vyššom tlaku ako pk premení sa voda v sýtu paru pri teplote tk, kritická izoterma tk je hranicou medzi vodou a prehriatou parou pri nadkritických tlakoch. Pri teplote vyššej ako je kritická teplota tk = 374°C, nemôže voda existovať v kvapalnom stave, všetky izotermy t > tk ležia v oblasti prehriatej pary.
Podľa definičných rovníc pre entalpiu a entropiu možno vypočítať pre každý stav, zadaný základnými stavovými veličinami, hodnotu entalpie a entropie a každému bodu v súradnicovom systéme p-v priradiť tak bod v súradnicovom systéme T-s, resp. i-s. Takto možno transformovať všetky krivky diagramu vodnej pary.
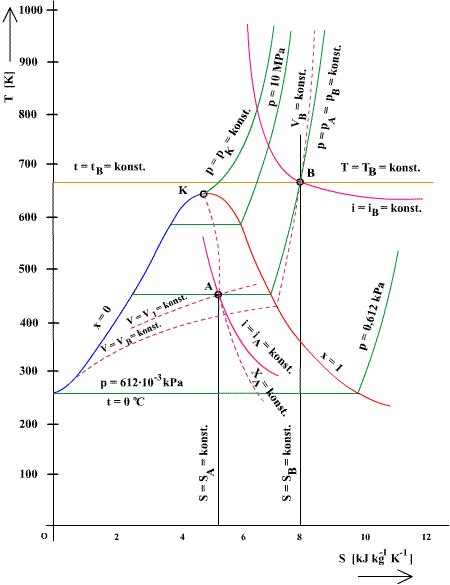
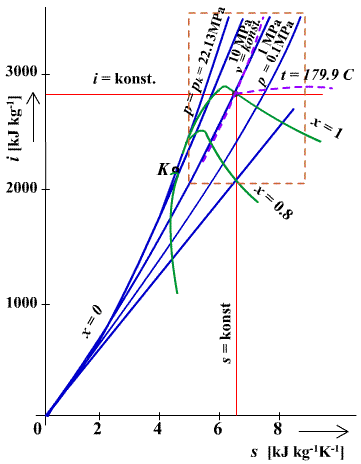
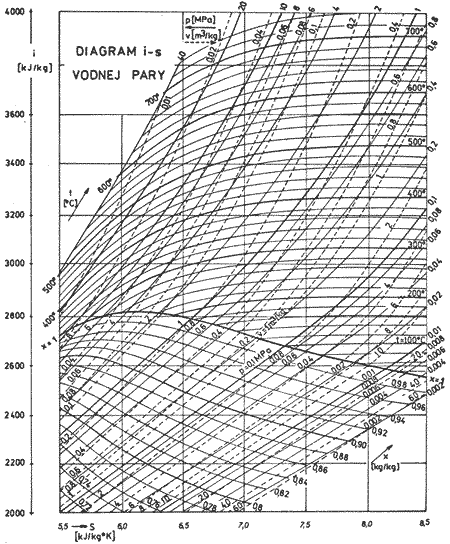
Diagram T-s je na obr. 6.3, diagram i-s na obr. 6.4. Parametre pary používané v parných motoroch sa nachádzajú len v časti celej oblasti diagramu, vyznačenej na obr. 6.4. čiarkovane. Pre lepšiu prehľadnosť sa používa v praxi len táto časť diagramu, ktorá je podrobnejšie rozkreslená na obr. 6.5.
Vypočítajú sa z veličín na dolnej (v', u', i', s') a hornej medznej krivke (v'', u'', i'', s''), ktoré sú uvedené v tabuľkách vodnej pary.
Z i-s diagramu vidieť (obr. 6.4), že izobary prakticky splývajú s dolnou medznou krivkou. Z toho vyplýva, že vlastnosti vody prakticky nezávisia od tlaku. Pre približné výpočty stačí zjednodušenie
Podobne môžeme približne predpokladať, že merný objem je lineárnou funkciou teploty
kde 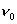 je merný objem pri teplote t0 = 0°C. je merný objem pri teplote t0 = 0°C.
Merné tepelné kapacity pri stálom tlaku a objeme sú vzhľadom na malú stlačiteľnosť vody prakticky rovnaké a v malom rozsahu teplôt ich môžeme považovať za konštantné, resp. pre väčší rozsah teplôt počítať so strednou hodnotou z daného rozsahu. Ďalej treba pripomenúť, že entalpia je množstvo tepla, potrebné na zohriatie 1 kg látky z nulového stavu (0°C) na daný stav (danú teplotu) pri konštantnom tlaku, teda
pretože sme definovali i0 = 0 pri t0 = 0°C.
Vnútorná energia z 1. zákona termodynamiky pre izobarický ohrev, p = const.
kde u0 = 0 pre t0 = 0°C.
Podľa hore uvedených rovníc je 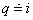 , potom , potom
čo je v súlade s definíciou entalpie.
Entropia
Stav mokrej pary je určený dvoma stavovými veličinami, najčastejšie tlakom a suchosťou x. Veličiny mokrej pary vypočítame z danej suchosti a veličín na dolnej a hornej medznej krivke.
Merný objem
Podobne počítame entalpiu a entropiu
kde r = i'' - i' je výparné teplo a
pretože v priebehu odparovania je T = T' = T'' = const.
Vnútorná energia
resp.
Stav prehriatej pary je určený dvoma základnými stavovými veličinami, najčastejšie tlakom a teplotou. Prehriatu paru možno pokladať za reálny plyn, ktorý má
Stavovú rovnicu najčastejšie vyjadrujeme v tvare
Taktiež adiabatický exponent
Používané sú stavové rovnice rôznych autorov.
Entalpia
kde cp je stredná hodnota v rozsahu t, t''.
Entropia
Vnútorná energia
kde 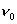 je objem vody pri tlaku p a teplote 0°C. je objem vody pri tlaku p a teplote 0°C.
obr.6.3 T-S diagram
|
obr.6.4 i-s diagram
|
obr.6.5 i-s diagram vodnej pary - pracovná oblasť
|
|

 Výučba
Termomechaniky
Výučba
Termomechaniky